FIFARMA lanza la segunda versión del informe W.A.I.T Indicator que mide los tiempos de acceso a medicamentos innovadores en LATAM
FIFARMA lanza la segunda versión del informe W.A.I.T Indicator que mide los tiempos de acceso a medicamentos innovadores en LATAM
Por FIFARMA
Accede al informe completo FIFARMA W.A.I.T. Indicator 2023
14 de febrero de 2024. La Federación Latinoamericana de la Industria Farmacéutica (FIFARMA) lanzó la segunda versión del FIFARMA W.A.I.T. (Waiting to Access Innovative Therapies) Indicator 2023 para Latinoamérica. Este estudio analiza el tiempo que esperan los pacientes latinoamericanos para acceder a medicamentos innovadores contra el cáncer y las enfermedades huérfanas. El proyecto se inspira en una iniciativa europea realizada por IQVIA para la Federación Europea de Industrias y Asociaciones Farmacéuticas (EFPIA) desde 2004.
El estudio analiza los tiempos de disponibilidad y aprobación de 228 tratamientos innovadores desde que son aprobados por las agencias regulatorias de Estados Unidos (FDA) y la Unión Europea (EMA) hasta que están disponibles para los pacientes en 8 países latinoamericanos: Argentina, Brasil, Chile, Colombia, Costa Rica, Ecuador, México y Perú.
El FIFARMA W.A.I.T Indicator destaca las disparidades en el acceso de los pacientes latinoamericanos a los medicamentos, revelando que el tiempo promedio de espera desde la aprobación de la FDA hasta la disponibilidad efectiva para los pacientes de la región, oscila entre 1,9 y más de 4,5 años. Actualmente, se estima que un tratamiento innovador contra el cáncer que reciba aprobación regulatoria en Estados Unidos en el mes de febrero de 2024, por ejemplo, podría estar disponible para los pacientes latinoamericanos en el segundo semestre de 2028.
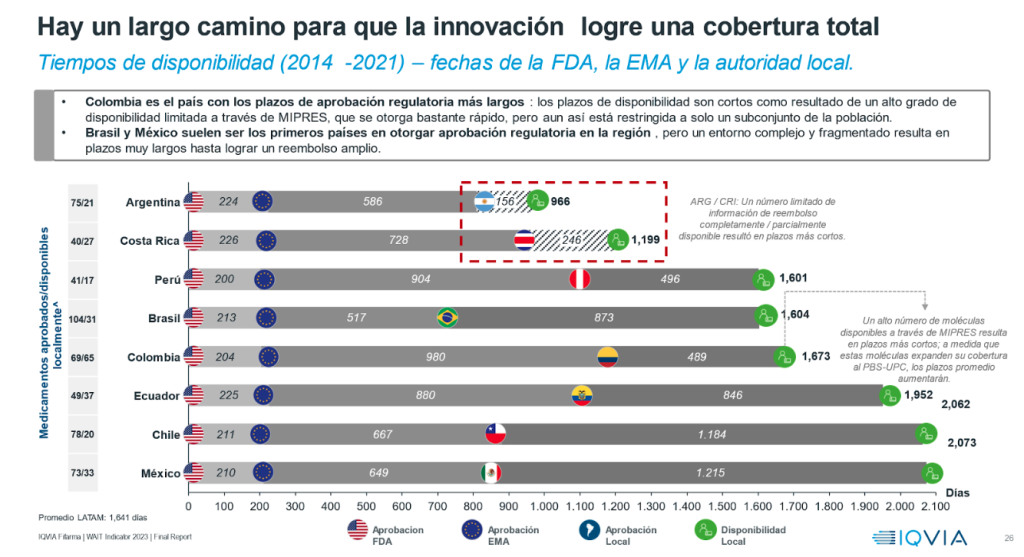
Adicionalmente, el estudio muestra que de los 228 medicamentos aprobados por la EMA y la FDA, solo 130 tienen aprobación regulatoria en algún país de América Latina y de éstos solo 86 están disponibles ampliamente en al menos uno de los mercados analizados.
Andre Ballalai, líder de acceso para IQVIA Latam afirmó: “El estudio revela que Colombia es el país con los plazos de aprobación regulatoria más largos. Asimismo, se evidencia que Brasil y México suelen ser los primeros países en otorgar aprobación regulatoria en la región, pero un entorno complejo y fragmentado resulta en plazos muy largos hasta lograr un amplio reembolso”.
Yaneth Giha, Directora Ejecutiva de FIFARMA, comentó: “Nuestra meta es lograr que los pacientes latinoamericanos accedan de manera amplia y equitativa a medicamentos innovadores. El informe resalta la importancia de la colaboración entre la industria farmacéutica, agencias gubernamentales, distribuidores, médicos y asociaciones de pacientes para mejorar el acceso a tratamientos. Juntos, podemos ofrecer esperanza a millones y asegurar que la innovación en salud beneficie a todos por igual.”
Este informe destaca los retrasos que enfrentan los pacientes en Latinoamérica al intentar acceder a tratamientos innovadores para cáncer y enfermedades raras. Cabe señalar que el estudio no profundiza en las razones detrás de estos retrasos. Este es un punto de inicio para motivar la colaboración entre los distintos participantes del sistema de salud regional, con el fin de identificar y abordar las causas de estos retrasos, mejorando así el acceso de los pacientes a las últimas innovaciones médicas y científicas.
Accede al informe completo FIFARMA W.A.I.T. Indicator 2023
Contacto de prensa:
María Alejandra De Guzmán
madeguzman@fifarma.org


