Tendencias en el Surgimiento de Vías de Confiabilidad en América Latina
Tendencias en el Surgimiento de Vías de Confiabilidad en América Latina
Por: Mario Alanís, PhD
Asesor Sénior, Centro para la Innovación en Ciencias Regulatorias (CIRS)
Lawrence Liberti, doctorado, RAC
Profesor Adjunto de Investigación, Asuntos Regulatorios y Control de Calidad
Programa de Posgrado, Facultad de Farmacia de la Universidad de Temple
Los últimos 5 años han atestiguado la previsión de las Academias Nacionales de Ciencias, Ingeniería y Medicina (NASEM por sus siglas en inglés) que cuando se trata de utilizar vías regulatorias basadas en la confiabilidad, la pregunta ya no es si esto ocurrirá, sino cuándo será una parte natural de la caja de herramientas del ente regulador (NASEM 2019). Y ahora vemos que ha llegado su momento. Los miembros del comité de expertos convocados por NASEM declararon en su informe de consenso que “la confiabilidad regulatoria es una de las mejores prácticas regulatorias del siglo XXI” no solo para las agencias con recursos limitados, sino también para las agencias con mejores recursos (Academia Nacional de Ciencias – NAS por sus siglas en inglés). Y América Latina se encuentra entre las regiones que están liderando el camino con usos innovadores de las vías de confiabilidad.
Las actividades basadas en la confiabilidad toman muchas formas, pero se pueden agrupar simplemente como: Actividades de Confiabilidad Horizontales (o bidireccionales) (por ejemplo, cuando las autoridades regulatorias confían en el trabajo de otros para tomar decisiones informadas, como la utilización de los informes de inspección de Buenas Prácticas de Manufactura – GMP relevantes de cada una). Este tipo de confiabilidad horizontal sustenta varias actividades de evaluación conjunta, en las que las agencias reúnen recursos para llevar a cabo diversas actividades regulatorias. Actividades de Confiabilidad Unidireccionales: Estas actividades se llevan a cabo entre un ente regulatorio con mejores recursos y otro con recursos limitados. Este último puede usar los productos de trabajo de una organización confiable para sustentar su propia toma de decisiones regulatorias. El grado de confianza puede variar, incluido el examen de informes y revisiones, la toma de decisiones nacionales independientes y la aceptación de decisiones de otras agencias con sólo verificar que el producto que recibe es el mismo que evaluó la agencia de confianza (Drago 2022) . Los conceptos de confiabilidad y reconocimiento y los diversos enfoques para su uso (es decir, verificación, evaluaciones de revisión abreviadas y completas) son evidentes en los enfoques que adoptan los entes regulatorios en toda la región de América Latina (OPS 2021).
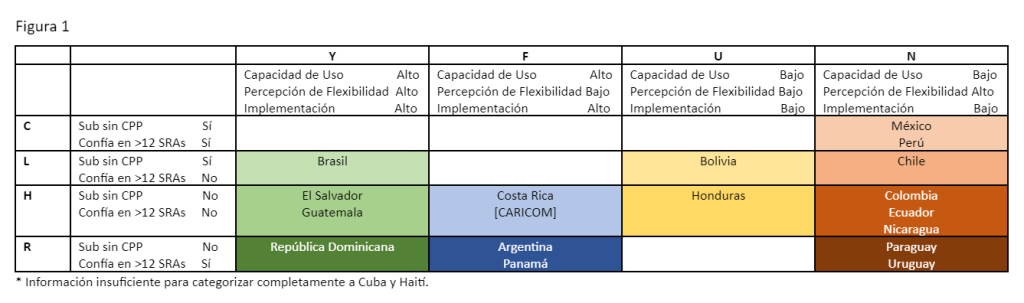
No todas las agencias en América Latina están optimizando el uso de las vías de confiabilidad, pero existen oportunidades para hacerlo. El estudio titulado Latin American Systems to Enable Reliance [Sistemas Latinoamericanos para Habilitar la Confiabilidad] (LASER por sus siglas en inglés) fue realizado por el Centro de Innovación en Ciencias Regulatorias (CIRS por sus siglas en inglés) para analizar los procesos de registro de confiabilidad para productos innovadores en América Latina mediante el desarrollo de un panorama detallado de los mecanismos de confianza disponibles en la región y la categorización de los países según las características clave. En su primera fase, LASER-1 evaluó 20 jurisdicciones sistemáticamente para identificar los atributos de estas agencias con relación a su uso de vías de confiabilidad. Al combinar factores descriptivos en un arquetipo consolidado, CIRS ilustró las similitudes entre las agencias y que, a medida que los procesos de confiabilidad se convierten más generalizados, existe una organización natural para aquellos países que podrían ser los más adecuados para trabajar conjuntamente para la implementación de vías basadas en la confiabilidad (Figura 1 ). LASER-2 ya está en marcha y ha sido diseñado para capturar la experiencia del mundo real de confiabilidad en América Latina para identificar las mejores prácticas para agencias y empresas de bots.
En 2021, el proyecto FRPath (www.frpath.org) identificó 27 Vías Regulatorias Facilitadas (FRP por sus siglas en inglés) (vías regulatorias diseñadas para acelerar la presentación, revisión y aprobación de medicamentos, al proporcionar alternativas a las rutas estándar de revisión regulatoria) de 15 países de América Latina (FR Path 2021). De estos, 24 facilitaron el proceso de revisión regulatoria y 21 se basaron en una decisión regulatoria previa y la mayoría (13) utilizaron una vía de confiabilidad en la que utilizaron una verificación abreviada del expediente para facilitar la revisión regulatoria. En estos casos, las decisiones previas de las autoridades de referencia sustentaron la decisión de la agencia. Cuatro vías aplicaron un enfoque de verificación, normalmente reservado para productos que son idénticos en naturaleza, indicación y etiquetado. Los FRP que requieren la realización de una revisión completa del expediente generalmente se asociaron con vías de uso de emergencia, aprobaciones condicionales o tipos específicos de revisiones prioritarias.
La OPS recomienda la implementación de procedimientos que permitan el uso de revisiones y confiabilidades conjuntas/colaborativas. Si bien los procedimientos que respaldan el uso de la confiabilidad pueden fortalecer la función regulatoria de la autorización para el mercado, continúan siendo subutilizados. Por lo tanto, la OPS ha recomendado el uso de mecanismos de revisión conjunta/colaborativa para reforzar la capacidad de revisión y apoyar la confiabilidad. Hay dos iniciativas regionales en América Latina y hay un país de la región que participa en una iniciativa global. En 2016, se estableció el Sistema Regulatorio del Caribe (CRS por sus siglas en inglés) para proporcionar recomendaciones centralizadas para la autorización de comercialización, el uso racional y el control de la calidad y la seguridad de los productos médicos en el Caribe. En 2019, se puso en marcha un Mecanismo de Evaluación Conjunta de Medicamentos en Centroamérica para realizar la revisión conjunta de nuevos medicamentos. buscando optimizar los recursos técnicos y la experiencia regional. También en 2019, se lanzó el Proyecto Orbis para la presentación y revisión simultánea de Productos oncológicos. Los países que actualmente participan en este proyecto son Estados Unidos, Australia, Singapur, Suiza, Canadá, Israel, Reino Unido y Brasil.
Las oportunidades de confiabilidad podrían basarse en iniciativas económicas regionales. Los mecanismos de integración comercial pueden facilitar el fortalecimiento regulatorio. Si bien existen desafíos importantes, también existen oportunidades para mejorar y aumentar el número de actividades regulatorias dentro de los mecanismos de integración de la Región (OPS 2021). Tales oportunidades pueden derivar de los vínculos existentes dentro de América Latina, tales como la Alianza del Pacífico, el Cono Sur y el Pacto Andino. Otra perspectiva de colaboración podría provenir del grupo de agencias de referencia regional de la OPS.
Es necesario que existan varios factores para que las vías de confiabilidad funcionen con éxito. Por ejemplo, Memorandos de Entendimiento y Acuerdos de Cooperación (Rodríguez 2022), marcos legales, marco organizacional adecuado y gestión e infraestructura. Las instituciones regulatorias requieren buena gobernanza y transparencia. Además, para que exista una confiabilidad efectiva, es necesario que existan sistemas para abordar la recopilación continua de datos sobre la seguridad de los medicamentos, sistemas para identificar eventos adversos y acciones de seguimiento, así como la capacidad de monitorear la calidad de los productos en el mercado. Los facilitadores de la confiabilidad incluyen el uso efectivo del Certificado de Producto Farmacéutico (CPP por sus siglas en inglés) electrónico, la aceptación de informes de evaluación redactados, la capacitación del personal sobre la confiabilidad del elemento y la alineación con los estándares regulatorios internacionales para generar confianza en los procesos de toma de decisiones regulatorias (OPS 2021).
Los entes regulatorios latinoamericanos han identificado la oportunidad de optimizar su efectividad y eficiencia a través de la disponibilidad de vías de confiabilidad. El uso de estas vías ahora ha comenzado a implementarse más ampliamente y se está investigando todo su potencial. Ofrecen la oportunidad de acelerar la disponibilidad de medicamentos innovadores en América Latina.


